В этой статье – практический гид для производителей еды, БАДов, косметики, медизделий и лекарств, выходящих на рынок США: какие элементы обязательны на этикетке, где граница между допустимыми и «лекарственными» заявлениями, как оформить Nutrition/Supplement/Drug Facts и UDI, как указывать аллергены (в т.ч. кунжут) и страну происхождения
Видео – визуальное дополнение к этой статье.
История одной ошибки
В 2023 году крупный производитель протеиновых батончиков отозвал 50000 упаковок продукции из американских магазинов. Проблема? На этикетке не был указан кунжут – новый девятый основной аллерген в США. Компания потеряла не только деньги на отзыв, но и репутацию. А всё из-за одной строчки на этикетке.
Такие истории случаются регулярно. Неправильная маркировка – одна из главных причин отказа в импорте и отзыва продукции в США. Этикетка кажется мелочью, пока не приходит письмо от FDA с требованием объяснений.
В этой статье простым языком разбираем, что должно быть на этикетке для рынка США, какие ошибки допускают чаще всего и как их избежать.
Почему это важно: цифры и факты
Масштаб проблемы:
- Более 30% задержек импорта в США связаны с проблемами маркировки
- В 2024 году FDA провело более 800 отзывов продукции из-за неправильных этикеток
Что проверяет FDA:
- Правильность названия продукта
- Полноту списка ингредиентов
- Указание аллергенов
- Наличие обязательной информации о производителе
- Соответствие заявлений на этикетке реальным свойствам продукта
Главное: FDA не утверждает этикетки заранее (за исключением новых лекарств). Вы сами несёте ответственность за соответствие требованиям. Если этикетка неправильная, продукт признают «misbranded» – неправильно маркированным, и это влечёт серьёзные последствия.
Золотое правило маркировки в США
Прежде чем углубляться в детали по категориям, запомните общие принципы, которые действуют для всех продуктов:
1. Английский язык обязателен
Вся обязательная информация должна быть на английском. Можете добавить другие языки, но английский – первичен.
Важный нюанс: если добавили второй язык, то ВСЮ обязательную информацию нужно продублировать на нём.
2. Честность превыше всего
Нельзя:
- Преувеличивать свойства продукта
- Скрывать состав или источник ингредиентов
- Использовать размытые формулировки типа «растительное масло» (нужно указать какое именно)
- Делать медицинские заявления, если вы не лекарство
3. Вся информация должна быть видна
Обязательные элементы размещаются так, чтобы покупатель мог их легко прочитать:
- Достаточный размер шрифта
- Контрастный фон
- Не закрываются дизайном или наклейками
4. Страна происхождения
Это требование не FDA, а таможни США (CBP), но без него продукцию не пропустят. Для импортных товаров нужна пометка «Made in [страна]» или «Product of [страна]».
Определите категорию вашего продукта
FDA делит все товары на категории, и для каждой свои правила. Определите, к какой категории относится ваш продукт:
- Пищевой продукт или напиток.
- Диетическая добавка (БАД)
- Косметика
- Медицинское изделие
- Безрецептурное лекарство (OTC)
- Рецептурное лекарство
Важно: некоторые продукты попадают сразу в несколько категорий. Например, солнцезащитный крем – это и косметика (украшает), и лекарство (защищает от солнца). Такие продукты должны соответствовать требованиям обеих категорий.
Пищевые продукты
Обязательные элементы
1. Название продукта
Не креативное маркетинговое, а описательное.
Не креативное маркетинговое, а описательное.
Неправильно: «Шоколадное счастье» Правильно: «Печенье шоколадное» или «Chocolate cookies»
2. Количество продукта
Указывается в американских и метрических единицах на лицевой стороне упаковки.
Указывается в американских и метрических единицах на лицевой стороне упаковки.
Пример: "Net Wt. 12 oz (340g)"
3. Список ингредиентов
Все компоненты перечисляются по убыванию массы.
Все компоненты перечисляются по убыванию массы.
Будьте конкретны:
Неправильно: «растительное масло»
Правильно: «подсолнечное масло»
4. Аллергены
С 2023 года в США 9 основных аллергенов:
С 2023 года в США 9 основных аллергенов:
- Молоко
- Яйца
- Рыба
- Ракообразные (креветки, крабы)
- Орехи (грецкие, миндаль и т. д.)
- Арахис
- Пшеница
- Соя
- Кунжут (новый с 2023)
Аллергены указываются либо в списке ингредиентов, либо отдельной строкой «Contains: milk, soy, wheat»
5. Панель Nutrition Facts
Стандартизованная таблица с информацией о калориях, жирах, углеводах, белках, витаминах и минералах.
Стандартизованная таблица с информацией о калориях, жирах, углеводах, белках, витаминах и минералах.
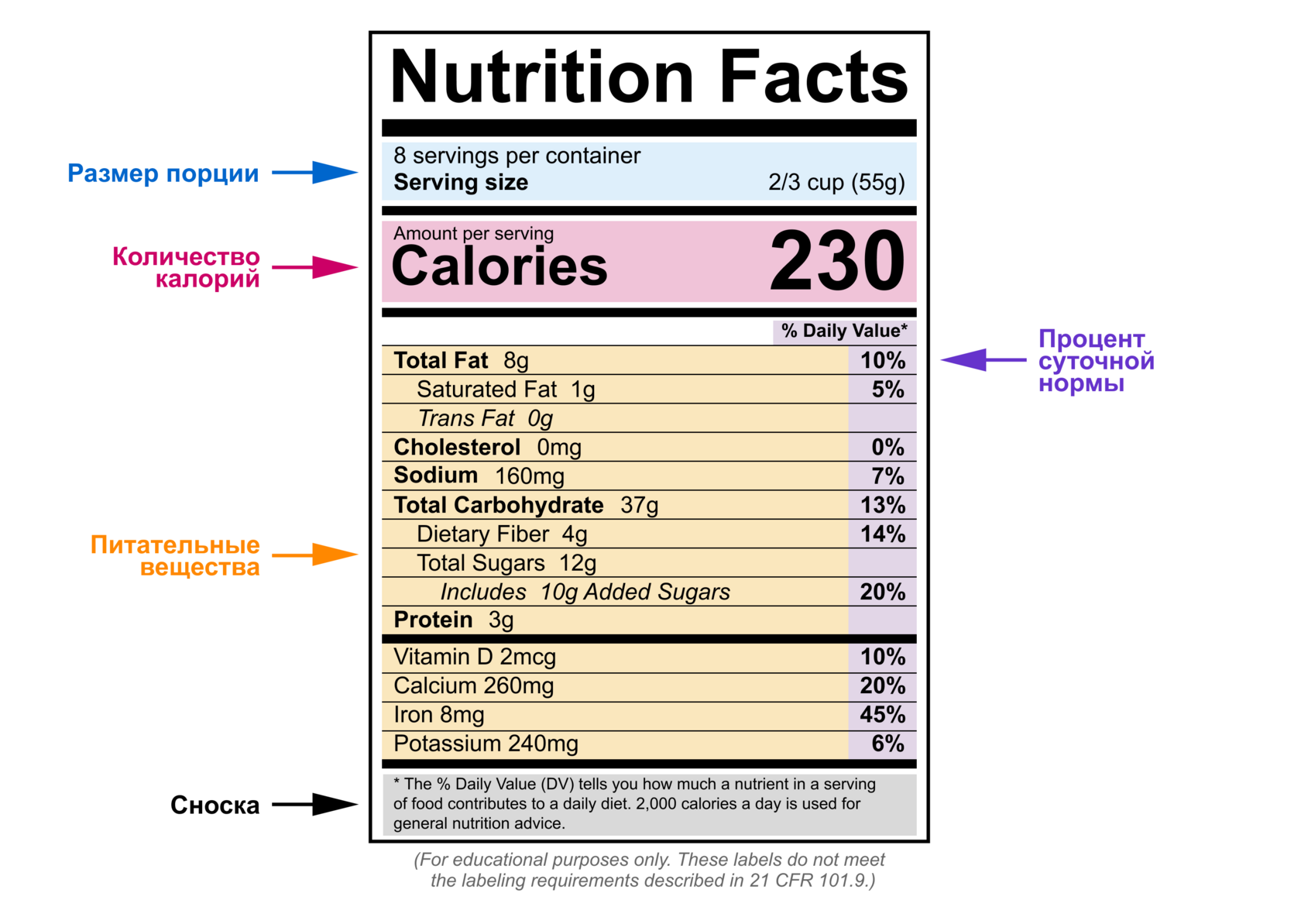
Важное изменение 2016 года: теперь обязательно указывать добавленные сахара отдельной строкой.
6. Производитель/импортёр
Название и адрес компании, которая произвела, упаковала или импортировала продукт.
Название и адрес компании, которая произвела, упаковала или импортировала продукт.
Типичная ошибка производителей
Кейс: Компания выпустила энергетический батончик с надписью «Без глютена». Но в составе был овёс, который хоть и не содержит глютен изначально, часто загрязняется им при обработке. FDA потребовало либо убрать заявление, либо доказать, что содержание глютена менее 20 ppm (частей на миллион). Партия была задержана на таможне на 3 месяца.
Совет: Любые заявления типа «без глютена», «низкий сахар», «органический» должны соответствовать строгим критериям FDA. Не пишите их просто так.
Диетические добавки (БАДы)
БАДы регулируются как пищевые продукты, но с особыми правилами.
Обязательные элементы
1. Панель Supplement Facts (вместо Nutrition Facts)
Показывает:
Показывает:
- Размер порции
- Количество порций в упаковке
- Активные ингредиенты и их количество
- % от суточной нормы (где применимо)
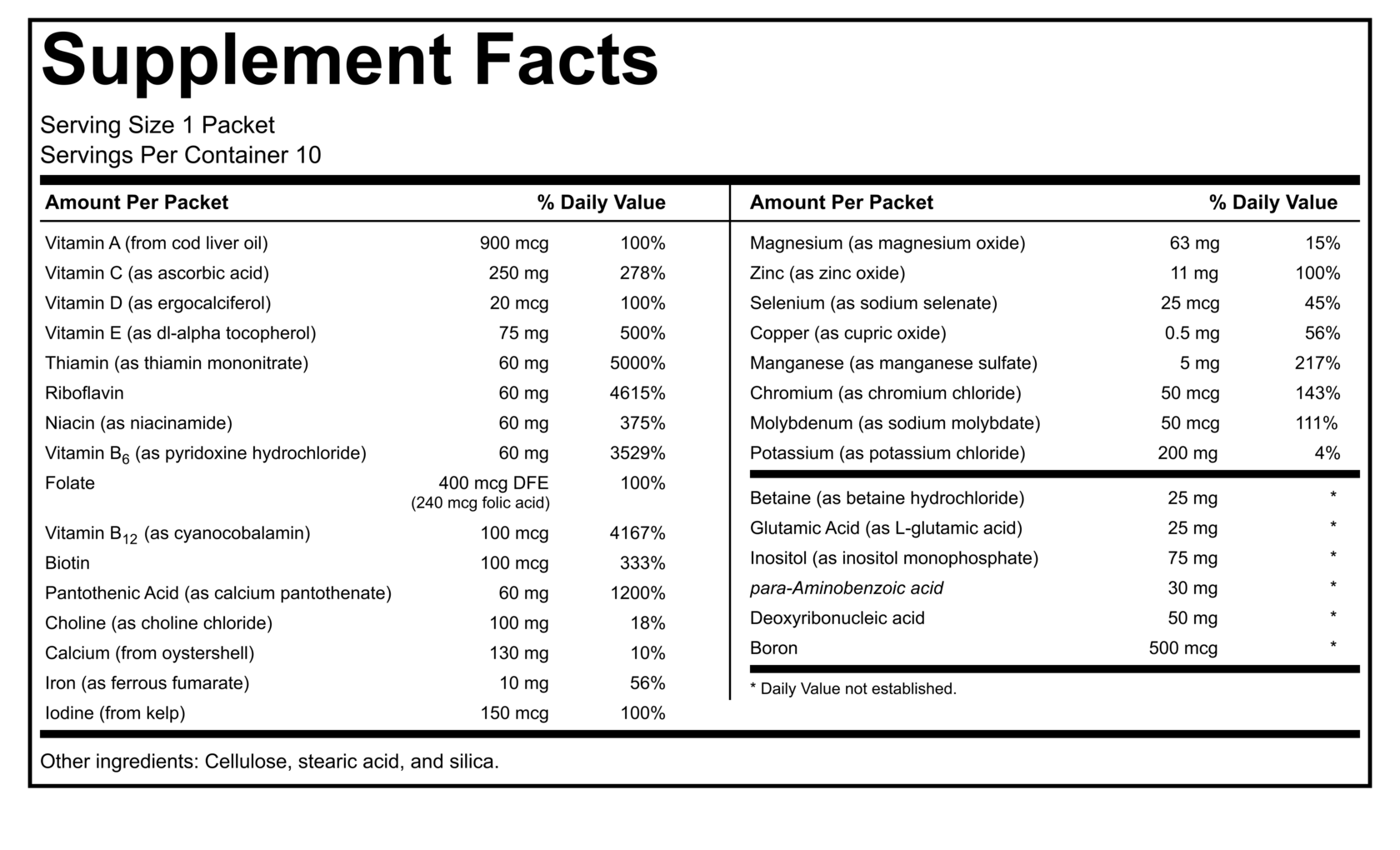
2. Список других ингредиентов
Наполнители, связующие, красители – всё, что не является активным компонентом.
Наполнители, связующие, красители – всё, что не является активным компонентом.
3. Дисклеймер (обязательно!)
Если вы делаете заявления о пользе (например, «поддерживает иммунитет»), на упаковке должен быть текст:
«Это заявление не проверялось FDA. Этот продукт не предназначен для диагностики, лечения или профилактики каких-либо заболеваний»
Если вы делаете заявления о пользе (например, «поддерживает иммунитет»), на упаковке должен быть текст:
«Это заявление не проверялось FDA. Этот продукт не предназначен для диагностики, лечения или профилактики каких-либо заболеваний»
Этот текст должен быть:
- Жирным шрифтом
- Размером не менее 1/16 дюйма (~1.6 мм)
- Рядом с заявлением о пользе
Важно: О таких заявлениях нужно уведомить FDA в течение 30 дней после начала продаж.
Важное ограничение: когда БАД становится лекарством
Недопустимые формулировки: «Лечит артрит», «Снижает холестерин», «Предотвращает диабет»
Можно писать: «Поддерживает здоровье суставов», «Способствует здоровому уровню холестерина», «Поддерживает нормальный уровень сахара в крови»
Разница заключается в формулировках: как только заявление касается лечения конкретного заболевания, продукт автоматически становится лекарством со всеми вытекающими требованиями.
Типичная ошибка
Кейс: Производитель БАДа написал на этикетке «Укрепляет иммунитет» и забыл добавить дисклеймер. FDA прислало письмо с требованием либо добавить дисклеймер, либо доказать лечебные свойства (что означает регистрацию как лекарства). Компания потратила $ 15000 на переработку всех этикеток.
Совет: Всегда добавляйте дисклеймер, если делаете любые заявления о пользе. Даже если кажется очевидным.
Косметика
С 2022 года вступил в силу закон MoCRA, который значительно ужесточил требования к косметике.
Обязательные элементы
1. Название и назначение
Что это и для чего.
Например: «Увлажняющий крем для лица»
Что это и для чего.
Например: «Увлажняющий крем для лица»
2. Количество продукта
3. Список ингредиентов
В порядке убывания по весу.
Исключение: красители и ингредиенты менее 1% можно указывать в любом порядке после основных.
В порядке убывания по весу.
Исключение: красители и ингредиенты менее 1% можно указывать в любом порядке после основных.
4. Контакты ответственного лица (НОВОЕ с 2024!)
На этикетке должен быть американский адрес, телефон или электронная почта для сообщений о побочных реакциях.
На этикетке должен быть американский адрес, телефон или электронная почта для сообщений о побочных реакциях.
5. Предупреждения
Для аэрозолей, красок для волос и других потенциально опасных продуктов — обязательны специальные предупреждения.
Для аэрозолей, красок для волос и других потенциально опасных продуктов — обязательны специальные предупреждения.
6. Страна происхождения
Для импортной косметики обязательна пометка страны-производителя.
Для импортной косметики обязательна пометка страны-производителя.
Типичная ошибка
Кейс: Производитель антивозрастного крема написал «Разглаживает морщины и восстанавливает клетки кожи». Фраза про восстановление клеток сделала продукт лекарством в глазах FDA, так как заявляет о воздействии на структуру тела. Продукцию остановили на таможне.
Совет: Косметика должна украшать, очищать или изменять внешний вид. Как только говорите о воздействии на функции организма или структуру тела – это уже лекарство.
Медицинские изделия
Если ваш продукт используется для диагностики, лечения или профилактики – это медицинское изделие.
Обязательные элементы
1. Производитель
Название и адрес. Если упаковано для другой компании – пометка «Manufactured for» или «Distributed by».
Название и адрес. Если упаковано для другой компании – пометка «Manufactured for» или «Distributed by».
2. Инструкция по применению
Понятные указания, как использовать безопасно: для чего, как, как часто, сколько.
Понятные указания, как использовать безопасно: для чего, как, как часто, сколько.
3. UDI – уникальный идентификатор
Это как штрих-код, но специальный. Состоит из двух частей:
Это как штрих-код, но специальный. Состоит из двух частей:
- DI (Device Identifier) – постоянный номер модели/производителя
- PI (Production Identifier) – переменная часть (партия, срок годности, серийный номер)
UDI наносится на:
- Этикетку
- Упаковку
- Само изделие (если многоразовое)
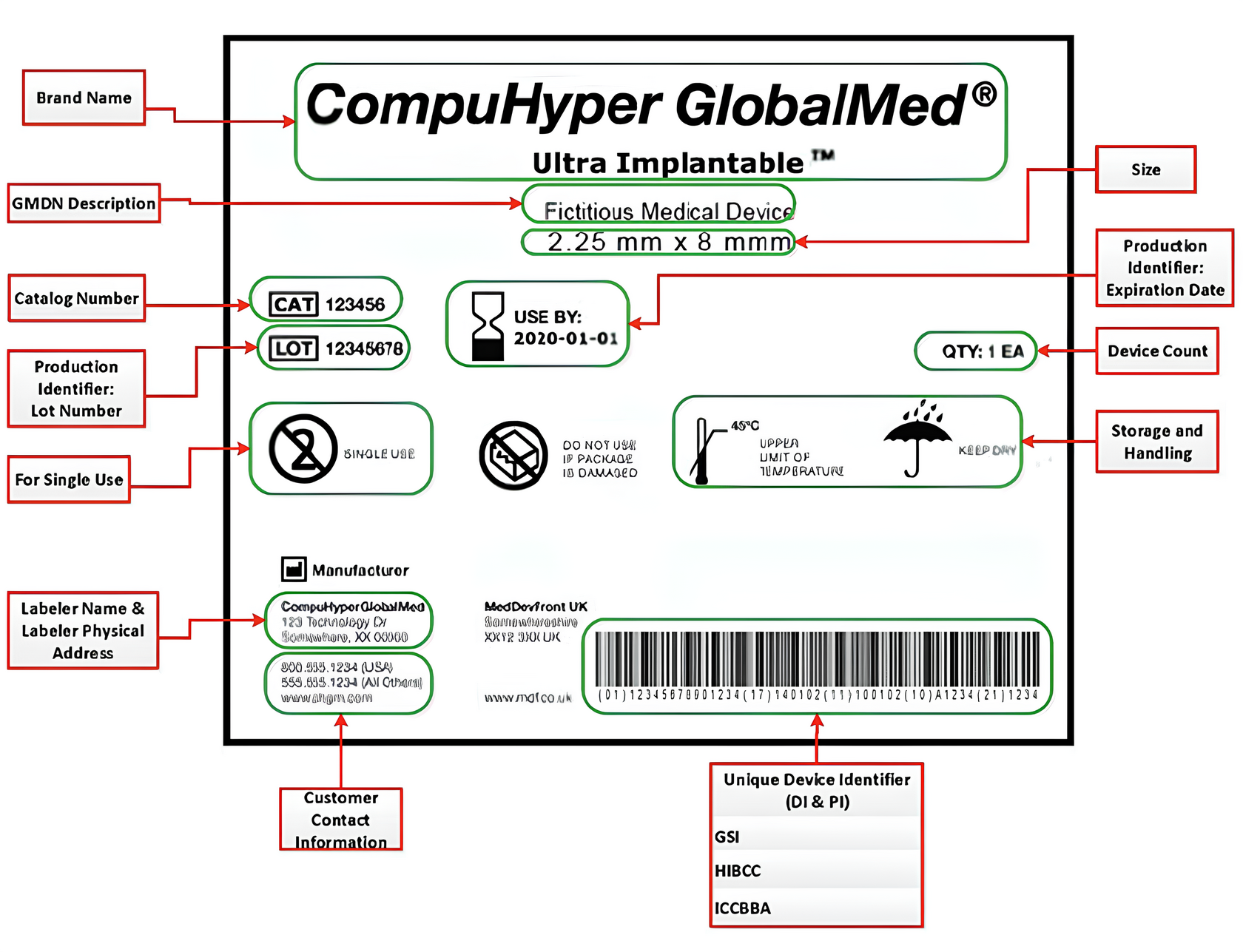
Важные даты:
- С 24 сентября 2023 – UDI обязателен для всех медизделий
- Старые коды NDC/NHRIC больше не действуют
4. Данные в GUDID
Информация о UDI подаётся в специальную базу данных FDA (GUDID). Это делается один раз при выводе продукта на рынок.
Информация о UDI подаётся в специальную базу данных FDA (GUDID). Это делается один раз при выводе продукта на рынок.
Типичная ошибка
Кейс: Производитель медицинских перчаток нанёс UDI только на коробку, забыв про отдельные пачки внутри. При проверке выяснилось нарушение – каждая потребительская упаковка должна иметь свой UDI.
Совет: UDI нужен на каждом уровне упаковки, который может быть продан отдельно.
Безрецептурные лекарства (OTC)
Если ваш продукт лечит симптомы и продаётся без рецепта – это OTC. Сюда относятся обезболивающие, средства от простуды, антациды, солнцезащитные кремы.
Панель Drug Facts
Это стандартизованный формат, который должен выглядеть одинаково на всех OTC-препаратах. Порядок разделов строго фиксирован:
- Drug Facts – заголовок
- Active ingredient (s) – действующее вещество и дозировка
- Purpose – для чего (анальгетик, антисептик и т. д.)
- Uses – какие симптомы лечит
- Warnings – кому нельзя, побочные эффекты
- Directions – как принимать
- Inactive ingredients – вспомогательные вещества
- Other information – условия хранения
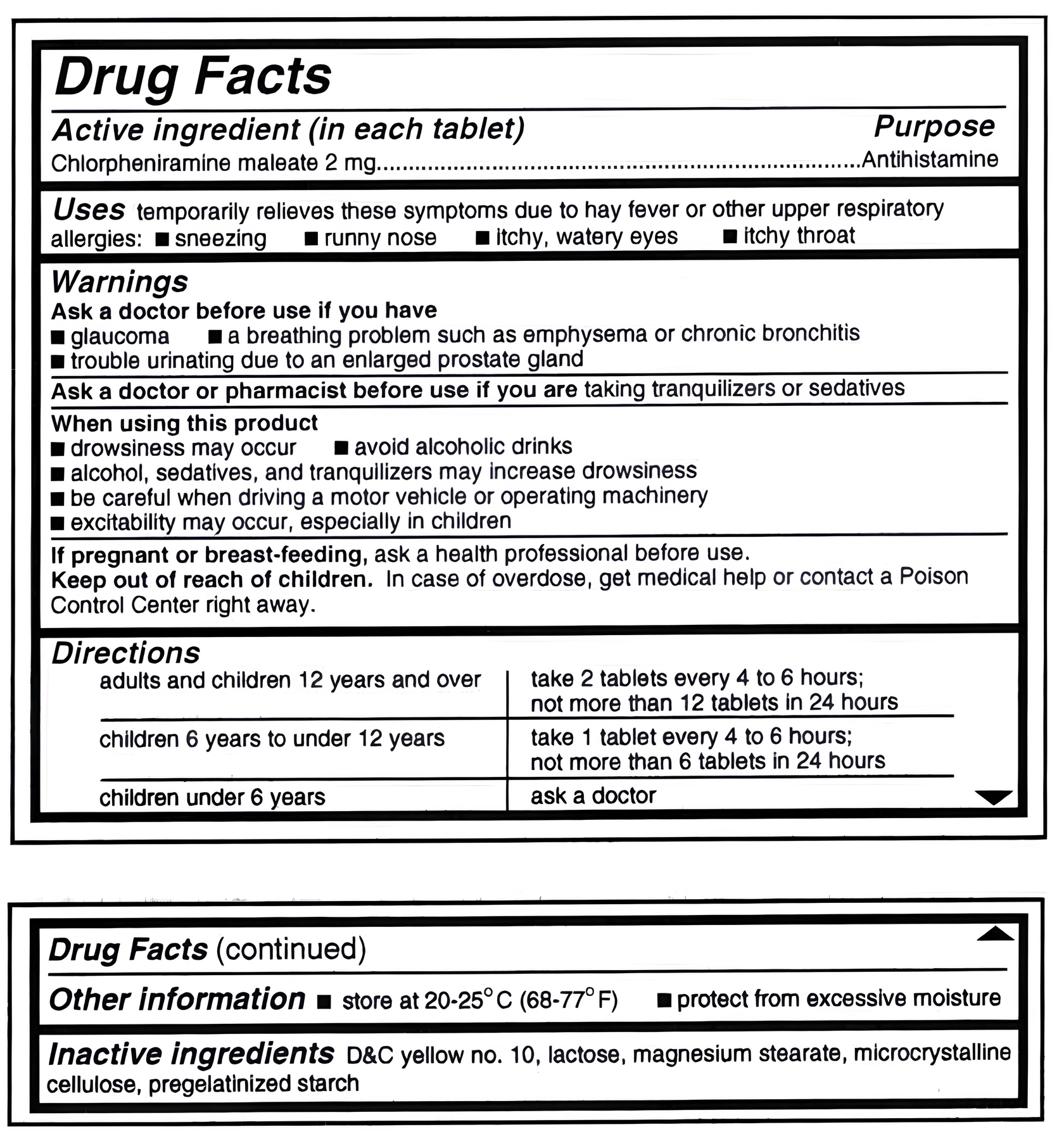
Дополнительно на упаковке:
- Срок годности
- Номер партии
- Защита от вскрытия (тампер-индикатор)
- Штрих-код с кодом NDC
- Производитель
Монография vs. NDA
Монография – это как утверждённая рецептура. Если ваш продукт точно соответствует существующей монографии (состав, дозировка, показания), предварительное одобрение FDA не нужно.
Если состав новый или не подходит под монографию – придётся подавать заявку (NDA/ANDA) и ждать одобрения FDA. Это долго и дорого.
Типичная ошибка
Кейс: Производитель витамина C написал на упаковке «Предотвращает простуду». Это лечебное заявление превратило витамин в лекарство, требующее панели Drug Facts и доказательств эффективности. Продукцию сняли с продажи до исправления этикетки.
Совет: Будьте осторожны с заявлениями. «Поддерживает иммунитет» (БАД) vs «Лечит простуду» (лекарство) – это разные категории с разными требованиями.
Рецептурные лекарства
Если ваш препарат отпускается по рецепту, этикетку утверждает FDA. Вы не можете просто напечатать её и начать продавать.
Что нужно
1. Инструкция для врачей
Состоит из двух частей:
Состоит из двух частей:
- Highlights – краткая выжимка: название, форма, основные показания, дозы, противопоказания, предупреждения
- Полная инструкция – детальное описание: как действует, при каких болезнях, как применять, побочные эффекты, взаимодействия
2. Информация для пациентов
Medication Guide – понятное объяснение, как принимать лекарство, на что обращать внимание.
Medication Guide – понятное объяснение, как принимать лекарство, на что обращать внимание.
3. Маркировка на упаковке
Название, доза, срок годности, условия хранения, производитель.
Название, доза, срок годности, условия хранения, производитель.
Важно: Всё это FDA рассматривает и утверждает в рамках регистрации лекарства (NDA/ANDA). Без одобрения – нет продажи.
Типичные ошибки и как их избежать
Ошибка: «Мы такие же, как в Европе»
Что случилось: Компания использовала европейскую этикетку с незначительными изменениями. FDA остановило партию, так как не было панели Nutrition Facts.
Как избежать: Этикетка для США разрабатывается с нуля. Европейские, китайские или стандарты стран СНГ не подходят.
Ошибка: «Растительное масло» без уточнения
Что случилось: В составе написали просто «vegetable oil». FDA потребовало уточнить – какое именно (подсолнечное, соевое, пальмовое).
Как избежать: Всегда указывайте конкретный источник. Общие названия не допускаются.
Ошибка: Лечебные заявления на БАДах
Что случилось: На витамине D написали «Лечит дефицит витамина D». Продукт стал лекарством, требующим регистрации.
Как избежать: БАДы могут только «поддерживать» функции, но не «лечить». Всегда добавляйте дисклеймер к любым заявлениям.
Ошибка: Креативное название
Что случилось: Протеиновый батончик называли «Energy Bomb», но нигде не было написано, что это protein bar.
Как избежать: Маркетинговое название – это хорошо, но обязательно добавьте описательное название продукта.
Ошибка: Мелкий шрифт
Что случилось: Список ингредиентов был напечатан шрифтом 4pt, который невозможно прочитать без лупы.
Как избежать: Минимальный размер шрифта для обязательной информации – 1/16 дюйма (~1.6 мм или примерно 6pt).
Сравнительная таблица: быстрая справка
Заключение: три главных вывода
1. Этикетка – это не дизайн, а юридический документ
Красивая упаковка привлекает покупателей, но правильная этикетка позволяет продукту вообще попасть на полки. Начинайте работу над этикеткой на этапе разработки продукта, а не перед отправкой в США.
Красивая упаковка привлекает покупателей, но правильная этикетка позволяет продукту вообще попасть на полки. Начинайте работу над этикеткой на этапе разработки продукта, а не перед отправкой в США.
2. Каждая категория уникальна
Нет универсальной этикетки «для FDA». Пищевой продукт, БАД, косметика и лекарство – это четыре разных мира с разными правилами. Определите свою категорию правильно с самого начала.
Нет универсальной этикетки «для FDA». Пищевой продукт, БАД, косметика и лекарство – это четыре разных мира с разными правилами. Определите свою категорию правильно с самого начала.
3. Лучше переспросить, чем переделывать
Исправление этикетки после производства партии стоит в десятки раз дороже консультации специалиста на этапе разработки. Если есть сомнения – обращайтесь к экспертам.
Исправление этикетки после производства партии стоит в десятки раз дороже консультации специалиста на этапе разработки. Если есть сомнения – обращайтесь к экспертам.
Нужна помощь с маркировкой для США?
Если вы готовитесь к выходу на американский рынок не рискуйте репутацией и деньгами – доверьте процесс сертификации опытным экспертам. Свяжитесь с нами для бесплатной первичной консультации.
Q&A
Можно ли использовать QR-коды и цифровые элементы?
Да, но они не заменяют обязательную информацию. Вся обязательная информация (название, ингредиенты, предупреждения, дозировки) должна присутствовать на физической этикетке.
Исключения:
Обязательно ли использовать английский язык?
Для продуктов, продаваемых в США, обязательная информация должна быть на английском языке. Допускается дублирование на других языках, если:
Нужно ли указывать страну происхождения?
Для косметики: обязательно для импортных продуктов
Для остальных категорий: требование страны происхождения контролируется не FDA, а таможней США (CBP). Маркировка страны на английском обязательна, если нет исключений.
Да, но они не заменяют обязательную информацию. Вся обязательная информация (название, ингредиенты, предупреждения, дозировки) должна присутствовать на физической этикетке.
Исключения:
- UDI обычно наносится в виде штрих-кода, Data Matrix или QR-кода
- Для некоторых медицинских изделий допускается электронная инструкция
Обязательно ли использовать английский язык?
Для продуктов, продаваемых в США, обязательная информация должна быть на английском языке. Допускается дублирование на других языках, если:
- Перевод точный
- Не уменьшает заметность обязательных элементов
- Вся обязательная информация присутствует на дополнительном языке
Нужно ли указывать страну происхождения?
Для косметики: обязательно для импортных продуктов
Для остальных категорий: требование страны происхождения контролируется не FDA, а таможней США (CBP). Маркировка страны на английском обязательна, если нет исключений.




