Безопасность медицинских изделий – один из главных приоритетов для производителей, регуляторов и пользователей. Международный стандарт ISO 14971 помогает системно управлять рисками, связанными с использованием медицинской продукции: от проектирования устройства до его вывода с рынка.
Актуальная версия стандарта была опубликована в 2019 году. В ней подробно описан поэтапный процесс оценки и снижения рисков: от выявления потенциальных опасностей до постмаркетингового мониторинга и повторной оценки остаточных рисков. ISO 14971 применяется ко всем видам медицинских изделий, включая программное обеспечение, in vitro диагностику и активные имплантируемые приборы.
В этой статье разбираемся, как устроен стандарт ISO 14971, как он помогает производителям снизить вероятность причинения вреда и довести уровень рисков до приемлемого, какие требования предъявляют регуляторы, и как документировать процесс риск-менеджмента в соответствии с ISO 13485 и европейским MDR.
Видео – визуальное дополнение к этой статье.
Процесс менеджмента рисков по ISO 14971: от проектирования до реального использования
Стандарт ISO 14971 описывает, как выстроить непрерывный и документируемый процесс менеджмента рисков, охватывающий весь жизненный цикл медицинского изделия. Актуальная версия 2019 года систематизирует этот процесс в виде логически связанных этапов – от определения политики до постмаркетингового анализа. Все шаги должны быть интегрированы в систему качества организации и регулярно пересматриваться.
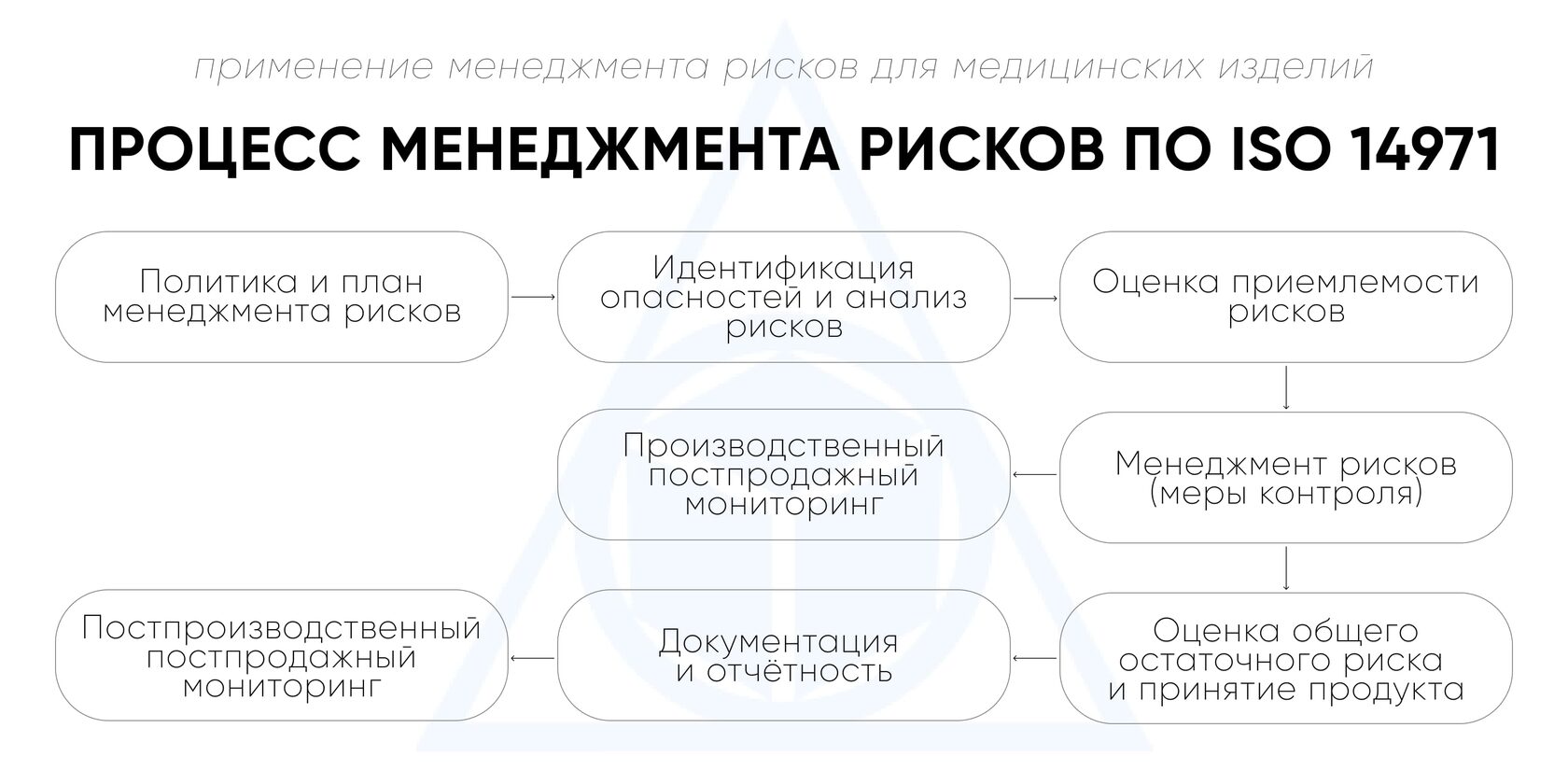
1. Политика и план менеджмента рисков
На первом этапе организация разрабатывает политику менеджмента рисков – документ, в котором устанавливаются критерии допустимости рисков, общие подходы к их оценке и снижению. Эта политика определяет рамки для всех дальнейших действий.
Затем для каждого изделия или проекта составляется план менеджмента рисков с указанием целей, области охвата, ресурсов, ролей, сроков и методов анализа. План должен учитывать специфику изделия и быть интегрирован в систему качества.
Важно обеспечить участие компетентных специалистов и выделить необходимые ресурсы. Уже на этом этапе управление рисками должно быть связано с другими процессами – разработкой, валидацией, постмаркетинговым наблюдением и др.
Для практической реализации требований ISO 14971 рекомендуется использовать ISO/TR 24971 – технический отчёт, который содержит подробные разъяснения и примеры применения стандарта.
2. Идентификация опасностей и анализ рисков
Задача этого этапа – выявить все возможные опасности, связанные с использованием изделия по назначению и при разумно предсказуемом неправильном применении.
Производитель должен учитывать механические, электрические, биологические, программные и пользовательские риски, включая ошибки применения (use error). Опасности анализируются с точки зрения их причин и последствий: например, короткое замыкание может привести к перегреву, ожогу, отказу или искажению результатов.
Для анализа применяются такие инструменты, как FMEA, FTA, HAZOP. Важно не только выявить угрозы, но и оценить риск по двум параметрам: вероятность и тяжесть вреда.
3. Оценка приемлемости рисков
Каждый идентифицированный риск сравнивается с критериями приемлемости, установленными в политике менеджмента рисков. Если уровень риска превышает допустимый – необходимо внедрить меры по его снижению.
ISO 14971 не устанавливает конкретных порогов, но требует, чтобы организация сама определила и обосновала критерии приемлемости. Эти критерии могут различаться в зависимости от характера рисков и стадии жизненного цикла изделия, а также применяться как к отдельным рискам, так и к совокупному остаточному риску.
Если после всех мер уровень остаточного риска остаётся выше установленного порога, допускается анализ соотношения «риск-польза». Производитель должен обосновать, что ожидаемая клиническая или общественная польза от применения изделия превышает оставшийся риск. Такой анализ особенно важен для критически значимых изделий, где снижение риска невозможно без потери эффективности.
4. Контроль и снижение рисков
Меры по снижению рисков реализуются в порядке приоритетов:
- устранение риска за счёт дизайна и конструкции (например, автоматическое отключение питания);
- использование защитных механизмов (ограждения, сигнализация, блокировки);
- инструкции, маркировка, обучение пользователей.
После внедрения мер риск переоценивается – был ли он действительно снижен до приемлемого уровня? Стандарт также требует оценить, не создают ли меры контроля новые риски. Например, дополнительная защита может ограничить доступ к важным функциям или вызвать путаницу у пользователей.
5. Общая оценка остаточного риска
После внедрения мер снижения рисков каждый отдельный риск подлежит повторной оценке – необходимо определить, удалось ли снизить его до приемлемого уровня. Если риск остаётся недопустимым, требуются дополнительные меры или переоценка конструкции.
Затем производится общая оценка совокупного остаточного риска изделия в целом – с учётом всех оставшихся индивидуальных рисков и их возможных взаимодействий. Это позволяет оценить безопасность продукта в комплексе, а не по отдельным сценариям.
Если совокупный остаточный риск превышает установленные критерии, изделие должно быть доработано, переработано или снято с производства. Если уровень риска признан приемлемым, оформляется отчёт по управлению рисками с обоснованием всех решений.
Кроме того, стандарт требует информировать пользователей о любом остаточном риске, который невозможно устранить, – через инструкции, маркировку и обучение.
6. Постпродажный мониторинг и обратная связь
Даже после вывода изделия на рынок, управление рисками не останавливается. ISO 14971 требует наладить систему сбора и анализа информации об эксплуатации изделия: жалобы, инциденты, отказы, результаты постмаркетингового надзора.
Эти данные обязаны стать основанием для повторного анализа рисков, внедрения новых мер или корректировки инструкции. Важно, чтобы механизм обратной связи был постоянным, документированным и сопряжённым с системой качества (включая ISO 13485).
7. Документация и соответствие
Весь процесс менеджмента рисков должен быть полностью задокументирован. Центральным элементом становится файл менеджмента рисков (Risk Management File) – структурированный комплект документов, подтверждающий, что организация выполнила все требования ISO 14971.
Состав Risk Management File может включать:
- план менеджмента рисков;
- описание назначения изделия и предполагаемого неправильного использования;
- перечень характеристик изделия, способных повлиять на безопасность;
- выявленные опасности и связанные с ними вреды;
- данные по оценке и анализу рисков;
- принятые меры по снижению рисков (если применимо);
- результаты верификации эффективности и реализации этих мер;
- результаты оценки остаточного риска (при необходимости);
- анализ соотношения риск-польза (если остаточные риски остаются высокими);
- оценку рисков от новых или вызванных опасностей (если появляются в процессе управления);
- итоговую совокупную оценку остаточного риска;
- финальный отчёт по управлению рисками;
- результаты оценки влияния мер управления качеством при анализе постмаркетинговой информации.
Документация регулярно проверяется как внутренними аудиторами, так и внешними органами по сертификации и регуляторами. Её наличие и полнота – важный элемент соответствия требованиям ISO 13485, MDR и других нормативных актов. Также это ключевое доказательство в случае претензий, отзывов или разбирательств.
Терминология ISO 14971: единый язык для менеджмента рисков
Для корректного применения требований ISO 14971 важно не только соблюдать последовательность этапов, но и одинаково понимать ключевые термины, которые используются в стандарте. Именно поэтому в версии 2019 года особое внимание уделено уточнению и расширению понятий, лежащих в основе системы менеджмента рисков. Эти определения обеспечивают общую понятийную базу для всех участников жизненного цикла медицинского изделия – разработчиков, инженеров, клиницистов, специалистов по качеству, регуляторов и аудиторов.
Основные термины, определяющие подход к менеджменту рисков:
Опасность (hazard)
Потенциальный источник вреда. Это может быть физический, химический, биологический, электрический или программный фактор, способный при определённых условиях нанести вред пользователю, пациенту, окружающей среде или имуществу. Примеры: утечка тока, перегрев, токсичность материалов, возможность перепутать стороны прибора.
Потенциальный источник вреда. Это может быть физический, химический, биологический, электрический или программный фактор, способный при определённых условиях нанести вред пользователю, пациенту, окружающей среде или имуществу. Примеры: утечка тока, перегрев, токсичность материалов, возможность перепутать стороны прибора.
Вред (harm)
Любое физическое повреждение или ущерб здоровью, а также ущерб имуществу или окружающей среде. Это конечное негативное последствие, которое должно быть исключено или сведено к минимуму. Вред может быть как обратимым (например, ожог), так и необратимым (например, инвалидизация или смерть).
Любое физическое повреждение или ущерб здоровью, а также ущерб имуществу или окружающей среде. Это конечное негативное последствие, которое должно быть исключено или сведено к минимуму. Вред может быть как обратимым (например, ожог), так и необратимым (например, инвалидизация или смерть).
Риск (risk)
Комбинация вероятности наступления вреда и тяжести его последствий. Часто выражается в виде функции: риск = вероятность x тяжесть. Например, маловероятный, но тяжёлый вред может считаться таким же значимым, как вероятный, но менее тяжёлый.
Комбинация вероятности наступления вреда и тяжести его последствий. Часто выражается в виде функции: риск = вероятность x тяжесть. Например, маловероятный, но тяжёлый вред может считаться таким же значимым, как вероятный, но менее тяжёлый.
Остаточный риск (residual risk)
Риск, остающийся после применения всех запланированных мер снижения. Даже при полном соблюдении стандартов и внедрении инженерных решений полностью исключить все риски невозможно – важно понимать, является ли остаточный риск приемлемым.
Риск, остающийся после применения всех запланированных мер снижения. Даже при полном соблюдении стандартов и внедрении инженерных решений полностью исключить все риски невозможно – важно понимать, является ли остаточный риск приемлемым.
Польза (benefit)
Положительный эффект от использования изделия. Это может быть улучшение состояния пациента, предотвращение заболевания, повышение точности диагностики или общественная польза (например, снижение нагрузки на систему здравоохранения). ISO 14971:2019 впервые ввёл этот термин как обязательный элемент при оценке приемлемости рисков.
Положительный эффект от использования изделия. Это может быть улучшение состояния пациента, предотвращение заболевания, повышение точности диагностики или общественная польза (например, снижение нагрузки на систему здравоохранения). ISO 14971:2019 впервые ввёл этот термин как обязательный элемент при оценке приемлемости рисков.
Соотношение риск-польза (benefit-risk balance)
Ключевой критерий, который помогает определить, стоит ли выводить изделие на рынок. Даже высокий риск может быть признан допустимым, если польза устройства значительно его превышает – при условии, что риск не может быть снижен иначе без потери эффективности.
Ключевой критерий, который помогает определить, стоит ли выводить изделие на рынок. Даже высокий риск может быть признан допустимым, если польза устройства значительно его превышает – при условии, что риск не может быть снижен иначе без потери эффективности.
Термины, уточнённые или введённые в версии 2019
Разумно предсказуемое неправильное использование (reasonably foreseeable misuse)
Новое определение, отражающее человеческий фактор. Производитель должен учитывать, как именно устройство может быть использовано не по назначению, но предсказуемо: например, путаница при подключении, ошибка дозировки, игнорирование инструкций. Эти сценарии необходимо учитывать наравне с правильным использованием.
Новое определение, отражающее человеческий фактор. Производитель должен учитывать, как именно устройство может быть использовано не по назначению, но предсказуемо: например, путаница при подключении, ошибка дозировки, игнорирование инструкций. Эти сценарии необходимо учитывать наравне с правильным использованием.
Ошибка использования (use error)
Непреднамеренное действие или бездействие, которое приводит к результату, отличному от ожидаемого. Это не всегда неправильное использование, а скорее – сбой, вызванный неудачным интерфейсом, сложностью управления или недостаточным обучением. Стандарт требует минимизировать такие риски, в том числе через эргономику и понятность пользовательского интерфейса. С этим напрямую связан стандарт IEC 62366 (Usability Engineering).
Непреднамеренное действие или бездействие, которое приводит к результату, отличному от ожидаемого. Это не всегда неправильное использование, а скорее – сбой, вызванный неудачным интерфейсом, сложностью управления или недостаточным обучением. Стандарт требует минимизировать такие риски, в том числе через эргономику и понятность пользовательского интерфейса. С этим напрямую связан стандарт IEC 62366 (Usability Engineering).
Современное состояние науки и техники (state of the art)
Ещё один ключевой термин, часто встречающийся и в ISO 13485, и в европейском регламенте MDR. Он означает уровень развития технологий, клинической практики и научных знаний, который считается актуальным на текущий момент. Производитель обязан опираться на «state of the art» при выборе материалов, решений и при анализе рисков. Этот уровень может меняться со временем – именно поэтому ISO 14971 требует регулярного пересмотра документации по рискам.
Ещё один ключевой термин, часто встречающийся и в ISO 13485, и в европейском регламенте MDR. Он означает уровень развития технологий, клинической практики и научных знаний, который считается актуальным на текущий момент. Производитель обязан опираться на «state of the art» при выборе материалов, решений и при анализе рисков. Этот уровень может меняться со временем – именно поэтому ISO 14971 требует регулярного пересмотра документации по рискам.
Использование единой терминологии критично при разработке, аудите и внедрении изделий. Неправильная трактовка понятий может привести к недостоверной оценке рисков и, как следствие, к угрозам безопасности. Стандарт ISO 14971 обеспечивает основу для системного и воспроизводимого анализа, понятного всем участникам процесса – от специалистов по валидации до регуляторных органов.
Почему ISO 14971 – основа безопасного медицинского изделия
Стандарт ISO 14971 – это не просто свод требований, а структурированное руководство для производителей, которое помогает выстроить системный и воспроизводимый процесс менеджмента рисков. Он охватывает весь жизненный цикл изделия: от замысла и проектирования до реального использования и постпродажного мониторинга.
ISO 14971 требует от производителей предвидеть возможные сценарии причинения вреда, оценивать риски, внедрять превентивные меры и регулярно проверять их эффективность. Такой подход делает безопасность не разовой проверкой, а частью повседневной работы компании.
Внедрение ISO 14971 позволяет:
- снизить вероятность инцидентов и отзывов продукции;
- повысить доверие со стороны регуляторов, пациентов и партнёров;
- обеспечить соответствие требованиям ISO 13485, MDR и других нормативных актов.
Сегодня ISO 14971 признан во всём мире как базовый стандарт в области безопасности медицинских изделий. Его применение – обязательное условие для производителей, которые стремятся выпускать конкурентоспособную и клинически надёжную продукцию.
Q&A
Как выглядит процесс менеджмента рисков по ISO 14971?
Практические шаги: план управления рисками → анализ (назначение, характеристики, опасности/ситуации) → оценка → контроль (выбор/внедрение мер, проверка эффективности) → оценка остаточного риска (по пунктам и «в целом») → пост-производственный мониторинг и обновления файла рисков.
Что должно быть в Risk Management File (RMF)?
План управления рисками, критерии приемлемости, отчёты анализа/оценки, протоколы выбора и верификации мер контроля, обоснование benefit-risk, решение по общему остаточному риску, а также записи постмаркет-наблюдения и обновления.
Какие типовые ошибки видят аудиторы и как их закрыть?
Частое: файл рисков «разовый» (нет связи с постмаркетом), нет явной общей оценки остаточного риска, критерии приемлемости не связаны с клинической пользой, слабая трассировка «опасность → мера → верификация».
Решение: обновляемый RMF, benefit-risk «по пунктам» и «в целом», протоколы эффективности мер, регулярный пересмотр (management review, PMS).
Практические шаги: план управления рисками → анализ (назначение, характеристики, опасности/ситуации) → оценка → контроль (выбор/внедрение мер, проверка эффективности) → оценка остаточного риска (по пунктам и «в целом») → пост-производственный мониторинг и обновления файла рисков.
Что должно быть в Risk Management File (RMF)?
План управления рисками, критерии приемлемости, отчёты анализа/оценки, протоколы выбора и верификации мер контроля, обоснование benefit-risk, решение по общему остаточному риску, а также записи постмаркет-наблюдения и обновления.
Какие типовые ошибки видят аудиторы и как их закрыть?
Частое: файл рисков «разовый» (нет связи с постмаркетом), нет явной общей оценки остаточного риска, критерии приемлемости не связаны с клинической пользой, слабая трассировка «опасность → мера → верификация».
Решение: обновляемый RMF, benefit-risk «по пунктам» и «в целом», протоколы эффективности мер, регулярный пересмотр (management review, PMS).




